作者:Sumithra乌尔斯博士|科学家,科学发展
日期:2019年6月
胰腺癌是第九最常诊断的癌症,是一个最致命的5年生存率最低的5 - 8%。(1、2、3)仅今年一年,美国癌症协会估计,将有56770人被诊断出患有的疾病超过45750人可能无法生存。胰腺导管腺癌(PDAC)是最普遍的和激进的形式的外分泌胰腺癌症占~发病率与死亡率相当于90%的病例。(4、5)
在诊断,绝大多数PDAC局部晚期患者,不可切除的,或转移性疾病。沉默的疾病的传播,和外观只在晚期疾病的具体症状,使早期检测非常具有挑战性,有助于低存活率。对可切除的患者治疗方法包括手术之后,第一行全身化疗(吉西他滨、FOLFIRINOX紫杉醇)或联合放化疗。对于局部晚期,不可切除的患者,多药化疗方案包括(研究者用,铂,伊立替康)或放化疗。[6]因为这些治疗胰腺癌患者提供有限的好处,新的选项如免疫治疗药物正在进行临床试验。
PDAC特点是纤维基质的存在,低突变负担,CD8的缺乏+T细胞的渗透和免疫抑制骨髓细胞群,所有这些都为典型的non-immunogenic肿瘤的特点。[7]电流的方法来提高治疗反应关注增加贩卖T细胞向肿瘤使用代理像放疗(RT)。RT,仅在大多数实体肿瘤,有可能激活免疫系统触发一个抗肿瘤免疫反应后死亡和释放细胞毒性免疫刺激信号。然而,在PDAC患者中,高剂量的结果仅RT,或结合化疗药物,仍普遍不满意[8]与代理单药免疫治疗和临床试验显示不良反应率低至1 - 2%。[9]至少21开放临床试验目前正在调查RT的结合与其他杂志专门代理可能是一种很有前景的PDAC方式治疗,值得进一步的研究。[10]沿着同一条直线,在基础平台上我们正在评估单一和联合疗法使金博宝188网址用Pan02鼠PDAC模型。Pan02是一个完善的三级腺癌模型开发的化学感应与3-MCA (3-methylcholanthrene)在雄性C57BL / 6小鼠。[11]在这个模型中关注我们在活的有机体内数据Pan02肿瘤生长动力学模型,对免疫调节抗体反应,震源辐射,和RT与免疫调节药物的组合测试的同源的C57BL / 6小鼠的压力。
Pan02生长参数
皮下植入Pan02导致成功的建立的肿瘤倍增时间中值为4 - 5天,小鼠植入后30天停留在研究~(图1),没有减肥(数据未显示)。生长动力学允许在一个为期三周的治疗窗评估抗肿瘤反应这个模型。

Immunophenotyping Pan02肿瘤通过流式细胞术分析证实了可怜的淋巴细胞渗透到肿瘤(图2),而CD8 + 和CD4 + 辅助T细胞构成CD45的只有1.6%和1% + 人口,分别免疫抑制骨髓细胞群中丰富。M-MDSCs M1和M2 tam占主导地位的细胞亚群。这个肿瘤免疫概要non-immunogenic或“冷”肿瘤模型的特征,类似于PDAC观察是什么病人。

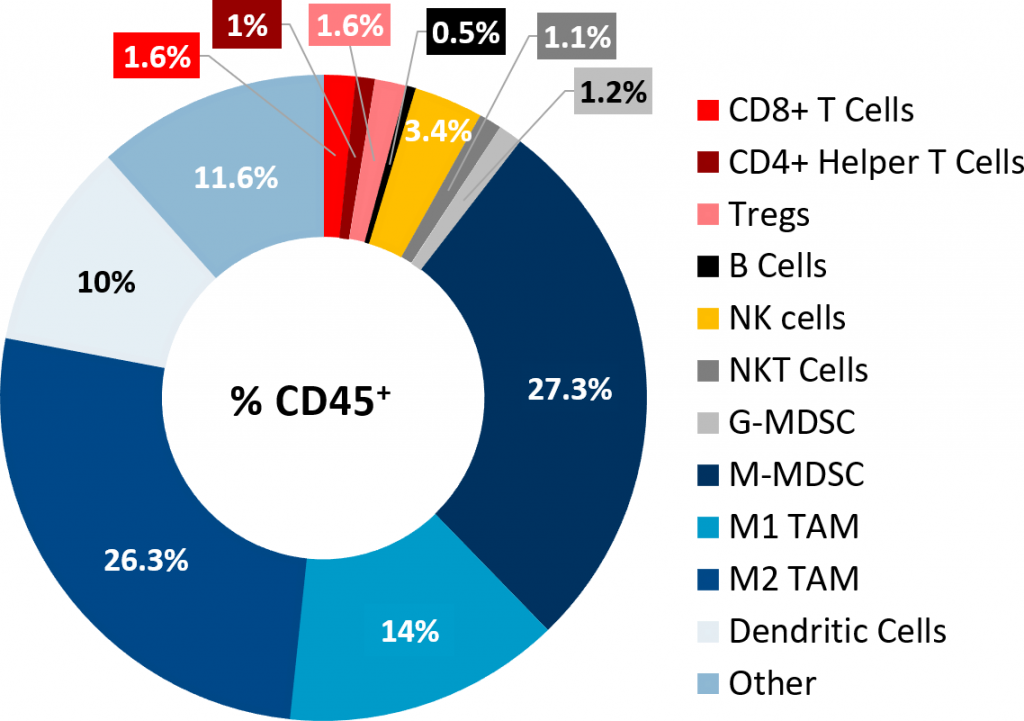
图2:肿瘤免疫的皮下Pan02肿瘤。
Pan02回应单药治疗
与吉西他滨单药治疗肿瘤Pan02轴承老鼠(100毫克/公斤,Q3Dx4),一个最常利用的胰腺癌患者的化疗,耐受性良好,产生统计上显著的肿瘤生长延迟(TGD)(图3)。

图3:Pan02对吉西他滨的回应。
鉴于PDAC临床调查免疫疗法,我们评估我们Pan02模型的响应各种immune-modulating抗体(图4)。然而,在免疫抑制的Pan02肿瘤,这是毫不奇怪,这个模型最小/不应对检查点抑制剂anti-mPD-1, anti-mPD-L1 anti-mCTLA-4, costimulatory抗体anti-mCD137 anti-mOX40。所有抗体每周服用两次10毫克/公斤总共4剂量(图4)。

图4:Pan02应对免疫调节抗体。
Pan02应对辐射和联合治疗
放射治疗通常管理PDAC病人。在小鼠模型我们使用小动物辐射研究平台(SARRP;Xstrahl)提供一个剂量的震源辐射(5 gy或10 gy)直接向肿瘤和我们观察到剂量依赖性肿瘤生长延迟9.5和22天,分别比未经处理的控制(图5)。
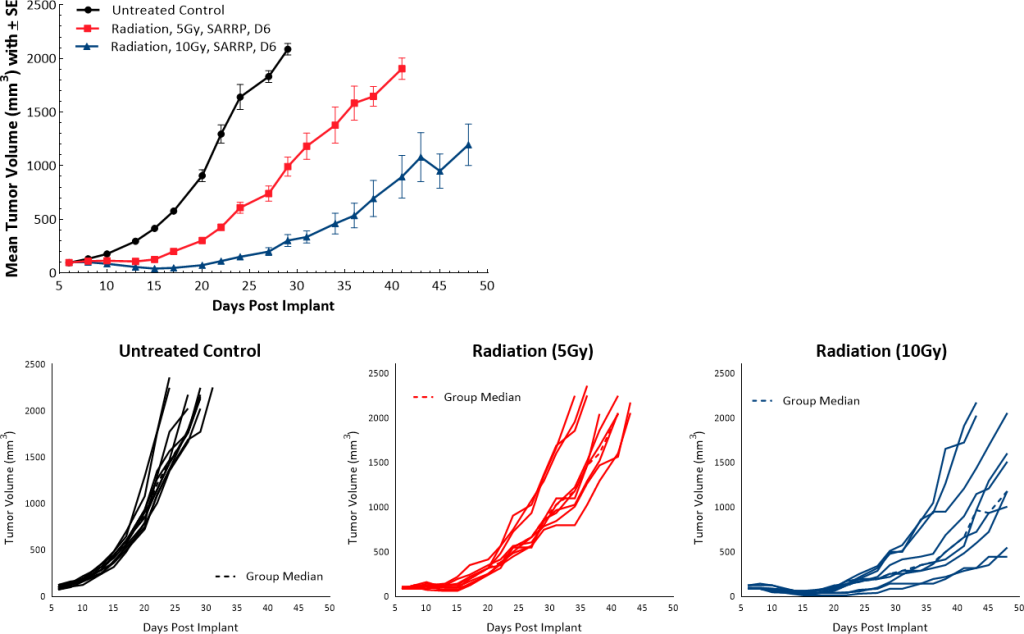
图5:Pan02应对震源辐射。
为了研究RT的抗肿瘤效应结合检查点抑制剂,单一剂量的5 gy anti-mPD-1一起使用或anti-mPD-L1抗体。未经处理的和同形像对照组显示重叠的增长率和单药治疗检查点抑制剂anti-mPD-1 anti-mPD-L1并没有引起任何抗肿瘤反应。虽然单剂量5 gy RT导致TGD 9.5天的未经处理的控制,结合检查点抑制剂没有明显有助于提高抗肿瘤反应。RT anti-mPD-1或anti-PD-L1导致TGD 13, 11.2天,分别为(图6)。
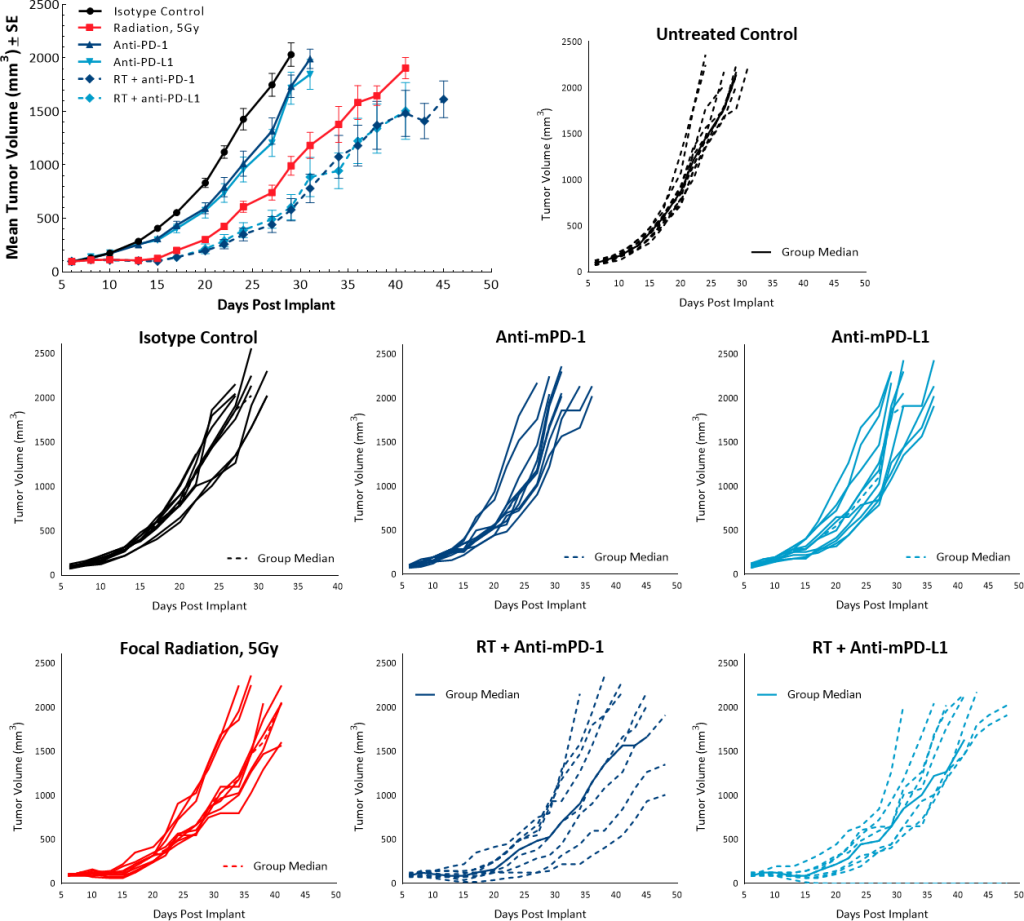
图6:Pan02应对辐射和检查点抑制剂的组合。
未来的工作与Pan02模型
研究正在进行中,以评估潜在的使用多个组合来提高治疗反应在皮下Pan02模型中。此外,我们最近产生了luciferase-enabled Pan02细胞系来支持研究原位设置。
引用
2SEER癌症统计事实。国家癌症研究所,国家卫生研究院。(https://www.cancer.gov)。
3胰腺癌行动网络(https://www.pancan.org/)。
4甘德森AJ,山崎T,麦卡蒂K et al。封锁的成纤维细胞激活蛋白结合放射治疗胰腺腺癌的小鼠模型。《公共科学图书馆•综合》2019,14 (2):e0211117。
5Kabacaoglu D, Ciecielski KJ,原来DA和Algul h .胰腺导管腺癌的免疫抑制检查站:当前限制和未来的选择。2018年免疫学前沿,9:1876。
6Saung MT和郑l .当前标准对于胰腺癌的化疗。中国。其他。2017年,39 (11):2125 - 2134。
7自由,Lim SY, D 'Costa Z et al。PD-L1封锁提高回应的胰腺导管腺癌放射治疗。EMBO分子医学2017年9 (2):167 - 180。
8Lauffer直流,库恩PA, Kueng M et al .胰腺癌:可行性和结果与高剂量放疗radio-chemotherapy后non-resected和R1切除的病人。2018年。Cureus 10 (5): e2713。
9Javle M,戈兰高地T和Maitra a改变胰腺癌的课程——关注最近转化进步。癌症治疗的评论。2016;44:17-25。
10-年代,道基森曾收到任务,Garrido-Laguna我,金赛C,劳埃德美国联合免疫治疗和放射治疗胰腺癌的策略——针对多个步骤在癌症免疫循环。J胃炎杂志,2018;9 (6):1014 - 1026。
让我们开始对话
联系我们