获得监管策略咨询和国内临床监护(ICCC)服务,使日本新型生物制药产品的最佳产品开发成为可能。
在日本制定健全的监管战略
我们与经验丰富的监管领导团队一起为您提交的文件的成功进行投资。你们的意见书以广泛的治疗领域和适应症的广泛经验和专门服务为依据。
- 了解日本不断变化的监管环境
- 使你的产品几乎同时获得全球监管机构的批准
- 获取关于获得SAKIGAKE指定、再生药物或孤儿药指定的快速批准的建议
促进日本新型生物制药产品的最佳发展
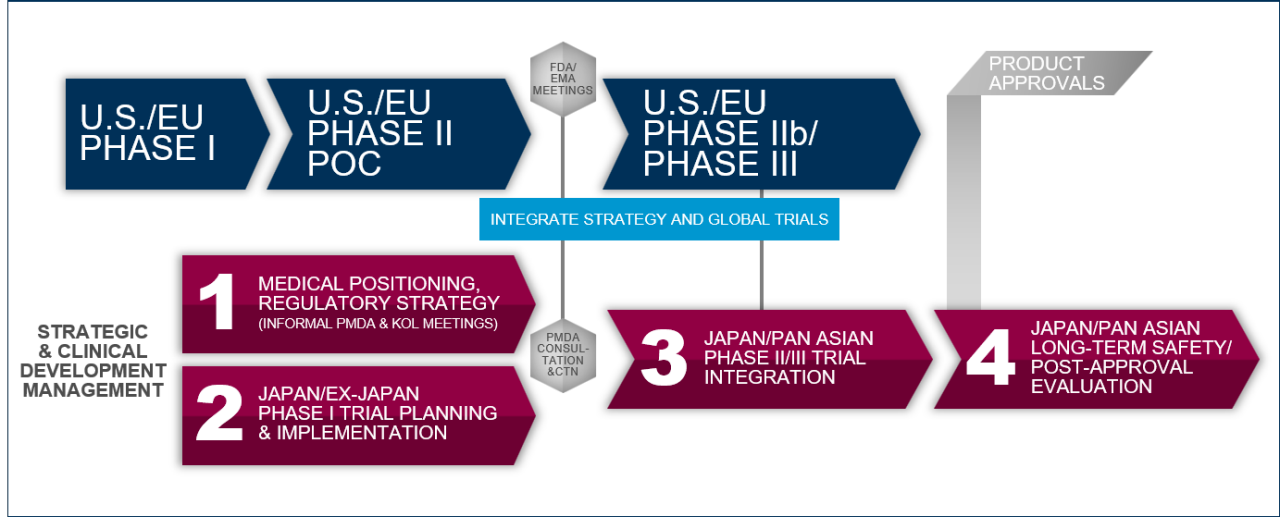
经过几十年的医疗实践的持续协调,以及日本厚生劳动省(MHLW)创建与美国和欧盟一致的监管框架的成功倡议,日本已经很好地融入了全球药物开发格局。
这一稳定的监管改革使日本融入美国和欧盟主导的药物开发项目成为可能,卫生部和药品和医疗器械机构(PMDA)现在带来了旨在将日本建立为解决高、未满足的医疗需求的突破性药物开发的全球领导者的动态举措。
利用其多学科的药物开发专家团队,我们不仅可以成功地将日本纳入全球药物开发项目,还可以与客户合作,导航这些新的监管途径,如SAKIGAKE,提前批准再生药物或支持产品指定为孤儿药。
让我们帮助您设计开发程序,增加您成功的机会。