作者:Erin Trachet |科学发展总监
日期: 2019年9月
乳腺癌仍然是全世界妇女中发病率最高、威胁生命的疾病之一。根据美国癌症协会的数据,2017年,在美国女性中,约有25.3万例浸润性乳腺癌新病例,导致4.1万人死亡大约6-10%的新乳腺癌病例(15000 - 25000)被诊断为转移性(第四期)。然而,据认为20-30%的乳腺癌会随着时间的推移发生转移
动物模型是分析癌症发展和进展的有力工具。其中一个例子是转基因多瘤中T癌蛋白(PyMT)模型。通过MMTV启动子/增强子,PyMT的表达仅限于乳腺,结果小鼠经历了从癌前到恶性的四个不同阶段的肿瘤进展。这些阶段与人类乳腺癌相当。除了形态学上与人类乳腺癌相似外,在mmtv - pymt诱导的肿瘤中,生物标志物的表达也与人类中与不良预后相关的表达一致。这包括在MMTV-PyMT肿瘤进展到恶性阶段时雌激素和孕激素受体的丧失以及ErbB2/Neu (Her2)和cyclinD1的持续表达
鉴于迫切的需求和MMTV-PyMT模型的独特性,Labcorp开发并优化了该模型的可移植版本,该模型来自转基因宿主小鼠(FVB/N-Tg(MMTV-PyVT)634Mul/J)。
原发性乳腺脂肪垫瘤生长
可移植MMTV-PyMT (PyMT)模型的原位原发肿瘤生长动力学如图1所示。中位加倍时间约8天,肿瘤体积稳步增加,无明显肿瘤相关体重下降。由于动物因原发肿瘤生长而被安乐死,可见肺结节。生长速度允许4周的治疗窗口期来评估抗肿瘤反应。
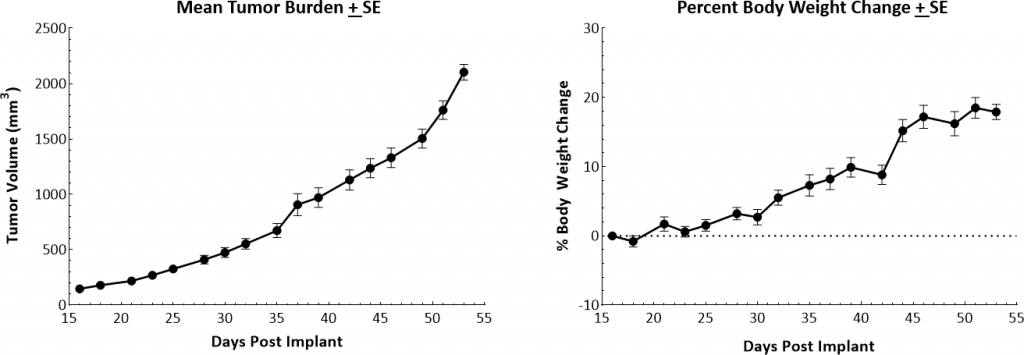
图1:雌性FVB/NJ小鼠体内MMTV-PyMT肿瘤生长动力学及体重变化。
PyMT肿瘤的免疫概况
基线肿瘤免疫成分分析187bet金宝搏如图2所示。淋巴细胞中CD8分布均匀+和CD4+T细胞。虽然NK细胞有相当多的存在,但B细胞和NKT细胞的表达最少。肿瘤有大量的髓系细胞,主要以G-MDSCs和m1 - tam为代表。CD8的浸润+T细胞和NK细胞支持PyMT模型可能对免疫调节剂有反应的理论。然而,在肿瘤微环境中也有大量的髓样抑制细胞。因此,我们测试了对免疫调节剂的反应(见图3),以确定PyMT模型是否更符合免疫抑制的“冷”肿瘤或免疫应答的“热”肿瘤。
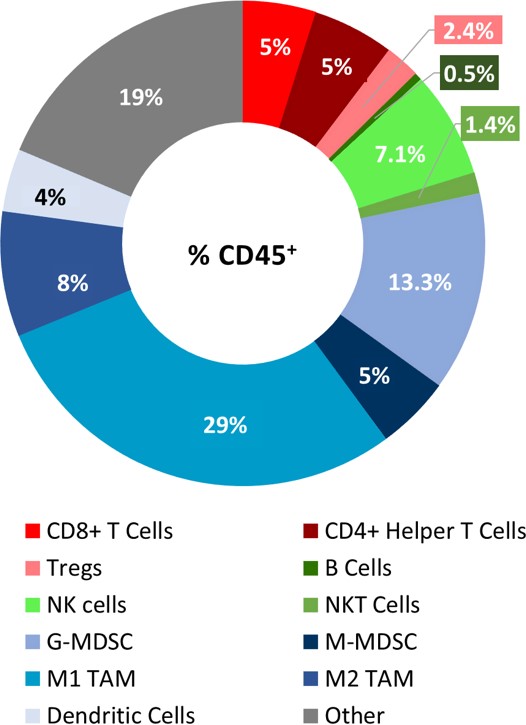
图2:PyMT肿瘤浸润的免疫图谱
对检查站封锁和局部放射治疗的反应
为了评估免疫调节剂的抗肿瘤反应,携带原位PyMT肿瘤的小鼠用检查点封锁抗体(抗mpd -1,抗mpd - l1和抗mctla -4)和震源辐射.单剂检查点抑制剂治疗反应温和,导致肿瘤生长延迟3-6天,但没有肿瘤复发(图3)。原位PyMT肿瘤对检查点抑制剂的治疗仅略微敏感,这为联合治疗提供了明显的机会,以显示额外的好处。此外,这些数据表明,该模型更适合“冷”的肿瘤概况。
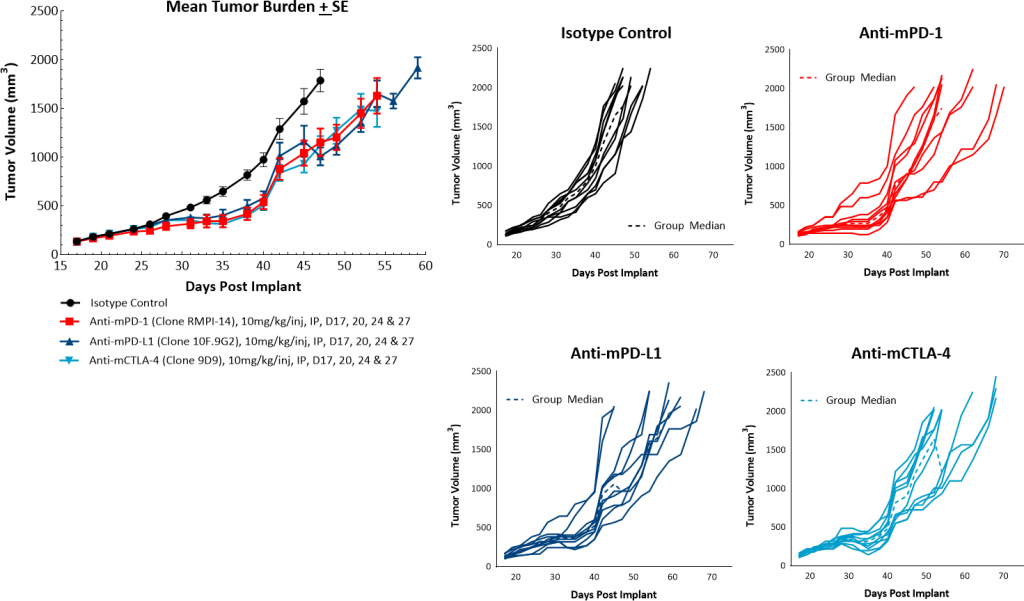
图3:PyMT对检查点抑制剂的反应。
除了检查点封锁外,聚焦束辐射也被认为是一种有效的治疗方法,可以改善免疫抑制肿瘤微环境。此外,放射治疗是许多乳腺癌患者的常用治疗方法。Labcorp利用小动物辐射研究平台(SARRP;Xstrahl)以与患者放射治疗一致的方式向小鼠提供局灶放射治疗。在这个模型中,我们测试了5、10或20Gy的单次聚焦辐射剂量,发现它们具有良好的耐受性和高度有效性。20和10Gy剂量水平都产生了强烈的抗肿瘤反应,完全应答者的发生率分别为100%和38%(图4)。基于此数据,建议在联合研究中使用单剂量5Gy局灶辐射。
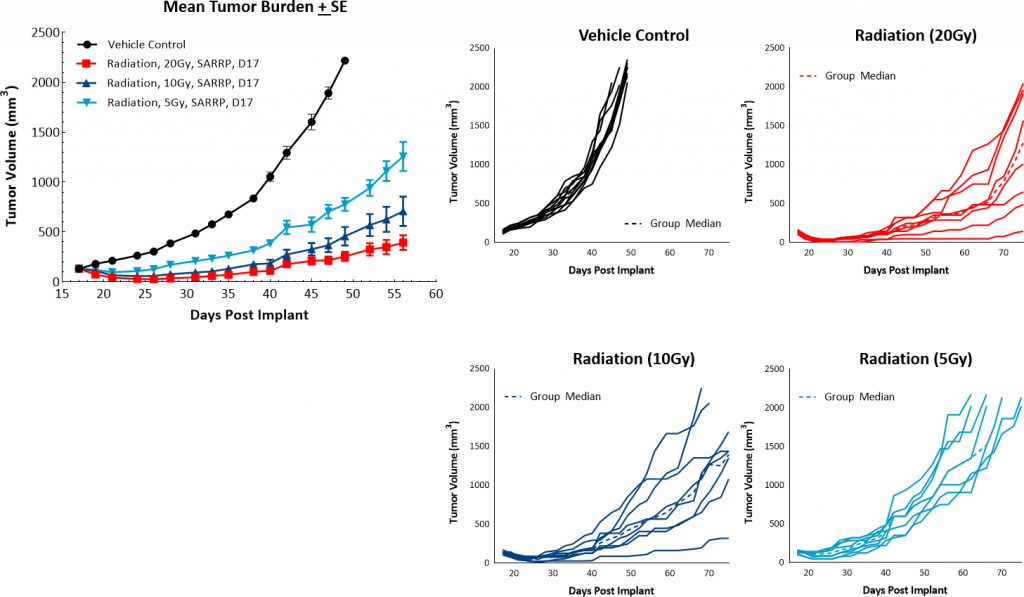
图4:PyMT对焦辐射的响应。
概述
可移植的PyMT是一种非常有用的评估乳腺癌药物的模型。该模型为研究界提供了利用模拟临床疾病的许多方面和复杂性的模型的能力。许多乳腺癌的临床治疗方法现在正在将免疫疗法和/或放射疗法作为正在进行的临床试验的一部分。我们在这里概述的数据表明,PyMT模型适用于检查点抑制剂或低剂量聚焦束辐射的联合研究。接触Labcorp了解更多关于我们提供的可移植的PyMT模型或其他乳腺癌模型的信息。
参考文献
连接
让我们开始对话吧
188 bet 服务中心

