作者:大卫·德雷珀,博士,科学发展部副主任
日期2022年2月
转录组分析可用于检测肿瘤微环境(TME)和免疫系统之间的相互作用,是研究免疫治疗机制作用的有力工具。在本次科技专题报道中,我们展示了如何使用nCounter®PanCancer IO 360™面板(NanoString Technologies)与流式细胞术相结合来测量实体肿瘤中的基因表达,以提供对免疫治疗对抗肿瘤免疫反应的影响的全面评估。
panccancer IO 360™面板是一个770 plex的基因表达面板,包括48个不同的基因签名,用于检查癌症相关的免疫反应。使用IO 360™面板进行分析,为肿瘤浸润免疫细胞、肿瘤细胞和相关微环境的检查提供了一种无偏和全面的方法。为了证明NanoString分析在应用于临床前研究时的效用,抗mpd -1(程序性细胞死亡1)治疗性抗体被注射到患有MB49肿瘤的小金博宝188网址鼠中,MB49是膀胱癌的小鼠模型。流式细胞术用于在不同免疫亚群中靶向各种促肿瘤和抗肿瘤活性的特定生物标志物。我们结合了细胞术和IO 360™面板结果,为分析添加了无偏成分,并提供了治疗与未治疗动物TME的整体免疫肿瘤基因表达谱。
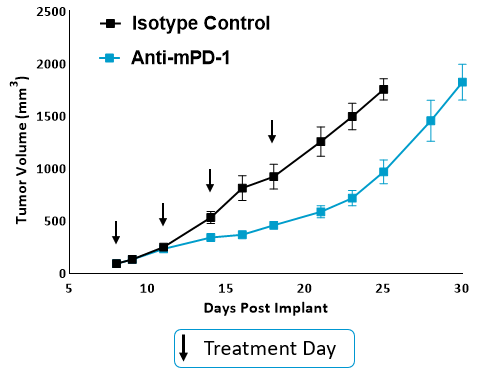
图。1。抗mpd -1和同型对照小鼠的肿瘤生长曲线。腋窝区皮下植入MB49细胞。抗mpd -1抗体(克隆RMP1-14)每周使用IP两次,共4次。用卡钳测量肿瘤进展情况。
MB49肿瘤浸润免疫亚群的流式细胞术分析
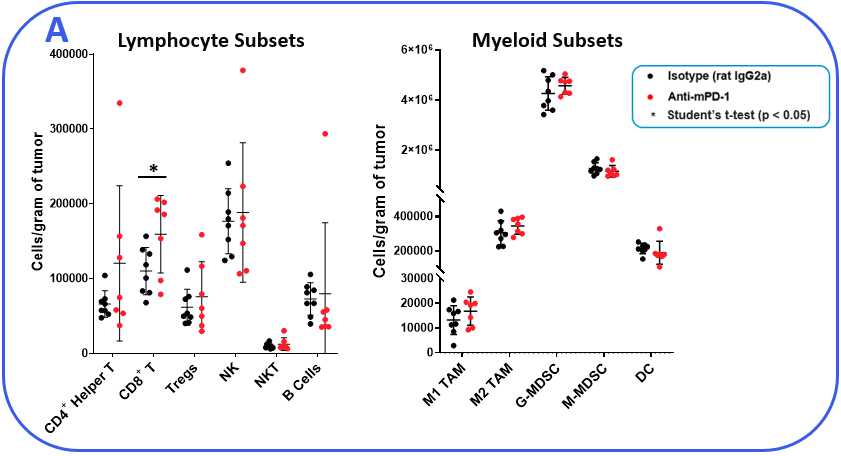
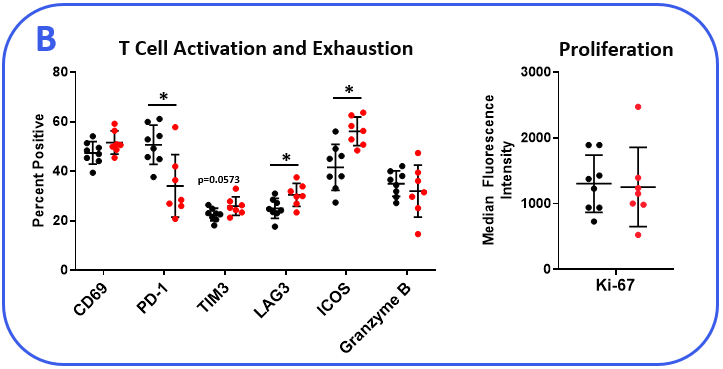
为了确定MB49模型是否对检查点抑制反应,荷瘤小鼠用抗mpd -1或同型对照抗体治疗。如图1所示的肿瘤生长曲线显示,MB49肿瘤对抗mpd -1治疗有中度反应。抗mpd -1治疗通过靶向PD-1/PD-L1轴来增强T细胞抗肿瘤活性,从而控制肿瘤生长。为了分析抗mpd -1在MB49模型中的作用,采用流式细胞术检测肿瘤浸润T细胞和其他亚群的绝对计数和表型。在测量的亚群中,只有CD8+与对照动物相比,T细胞增加(图2A)。为了深入了解CD8的活性+检测T细胞、激活标志物CD69、诱导共刺激因子(ICOS)和颗粒酶B的表面表达。为了评估T细胞增殖能力,我们量化了Ki-67在细胞内的表达。最后,测量与T细胞衰竭相关的标记物,包括PD-1、淋巴细胞激活基因3 (LAG-3)和T细胞免疫球蛋白和粘蛋白结构域含-3 (TIM-3)(图2B)。与对照组相比,抗mpd -1治疗的肿瘤浸润T细胞表达了更高水平的ICOS, ICOS是一种受体,向T细胞提供共刺激信号,促进它们的扩张和生存1.值得注意的是,抗mpd -1治疗也调节了T细胞衰竭标志物,观察到PD-1表达减少,但在治疗动物中LAG-3和TIM-3水平增加。流式细胞术也用于测量与髓样细胞亚群活性相关的靶点。iNOS和ARG1蛋白介导骨髓源性抑制细胞(MDSC)的免疫抑制活性2.这两种蛋白的表达也与肿瘤相关巨噬细胞(TAM)极化相关,iNOS和ARG1分别是M1和M2 TAM极化的标记物2.流动分析表明,与对照组相比,抗mpd -1处理动物的TAMs中iNOS表达增高,而ARG1表达增高。在两组间肿瘤源性TAMs、粒细胞(G-)或单核细胞(M-) MDSC亚群中,ARG1的表达水平未见明显变化。CD80和CD86是抗原呈递细胞上的共刺激分子,为T细胞提供激活信号,通常被作为树突状细胞(DC)抗原呈递能力的生物标志物。我们测量了DC1和DC2细胞上的CD80和CD86,这是在肿瘤中起作用的主要传统树突状细胞亚群,发现抗mpd -1并没有增强这些共刺激分子的表达。事实上,DC2亚群中CD80的表达减少了(图2C)。
空间
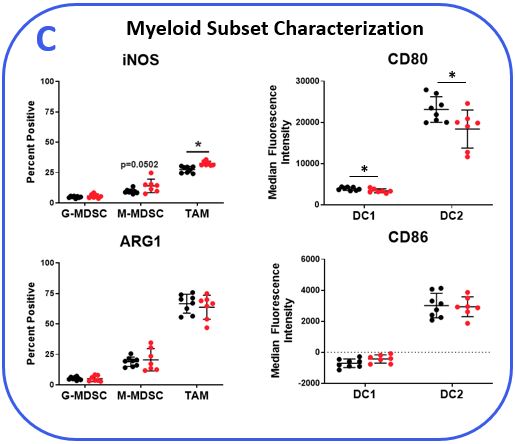
图2。MB49肿瘤来自抗mpd -1和同型对照抗体处理的小鼠。(A)使用流式细胞术和标准门控策略(未显示)勾画肿瘤浸润免疫亚群。使用CountBright™珠(赛默飞世尔科学公司)测定绝对计数。(B-C)流式细胞术对淋巴细胞和髓系免疫亚群的功能表征。根据DC总分中CD103和CD11b标记的阳性分别划分DC1和DC2亚群。*学生T检验(p<0.05)。
使用nCounter®PanCancer IO 360™面板检测MB49肿瘤中的基因表达
为了从转录组学角度了解抗mpd -1治疗对MB49 TME的影响,从治疗开始后12天收集的肿瘤FFPE块中提取mRNA。样品分析在NanoString nCounter®平台和鼠标PanCancer IO 360™面板上进行。由ROSALIND™生物信息学支持的分析确定,770个基因中有62个在抗mpd -1和同型对照抗体治疗组之间存在差异表达。此外,IO 360™小组检测的48个基因特征的通路分析分配了一个全局显著性评分,以评估每个基因集的差异表达的总体水平。表1显示了被广泛调节的基因集,其中包括干扰素信号、细胞毒性、细胞因子和趋化因子信号签名。值得注意的是,在抗mpd -1治疗组中,所有这些组中的调控基因都上调了。图3用热图格式描绘了这些基因集,以帮助可视化抗mpd -1治疗对基因表达的影响。组成干扰素信号基因集的61个基因中有9个在治疗组之间表达差异。值得注意的是,该列表中大多数被调节的基因都是STING通路信号转导的中介基因,包括Ifih1、Stat1、Ifit1、Ifit2、Ifit3和Irf73、4.构成细胞毒性基因集的50个基因中有10个表达差异,还包括一些STING通路相关基因。构成细胞因子和趋化因子信号基因集的106个基因中,有14个在抗mpd -1治疗调节的62个基因中。包括促进T细胞存活的基因(Il2rb, Il21r, Il7r, Il10ra),以及DC和T细胞向肿瘤募集的基因(Ccl4, Ccl5, Ccr5)5 - 8.进一步的数据分析表明M1巨噬细胞谱增加(no2, Tlr8, Tlr9, Stat1)9.最后,编码免疫调节已知临床靶点的基因(Ido1、Tim3和Csf1r)增加,表明TME努力抵消抗mpd -1治疗的效果。
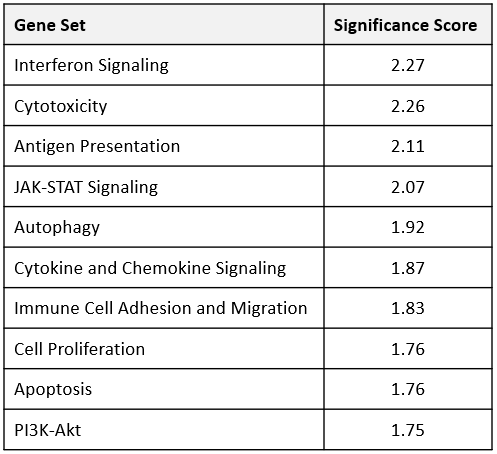
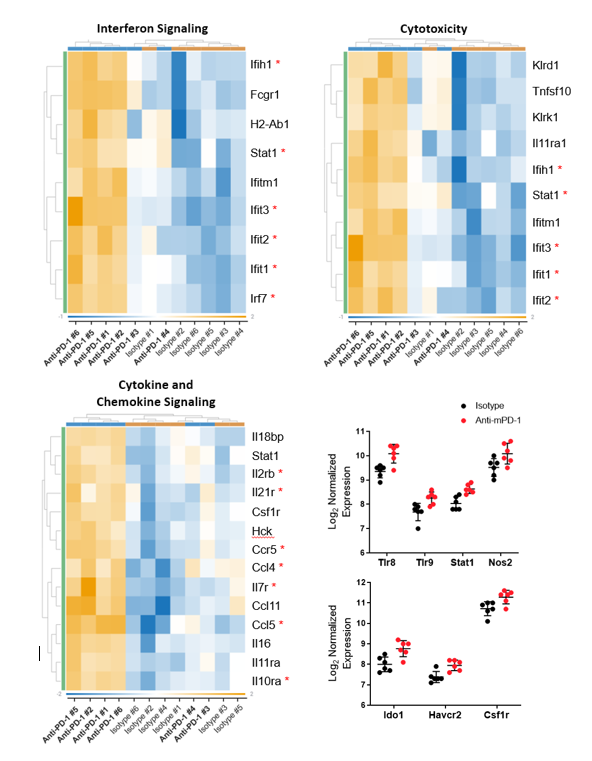
图3。与对照动物相比,抗mpd -1治疗小鼠MB49肿瘤中差异表达基因的转录组学分析。对原始基因计数进行Log2转换,并对20个管家基因进行归一化处理。差异表达标准为±1.5倍变化,p < 0.05。*表示文中讨论的基因。
总结
总之,我们使用转录组分析来评估抗mpd -1治疗如何改变MB49膀胱癌模型中与免疫反应和TME相互作用相关的基因表达。结合肿瘤浸润免疫细胞的流动分析,转录组学对抗mpd -1治疗诱导的肿瘤生长抑制提供了深入和全面的机制洞察。
血流分析证实CD8+与对照组相比,抗mpd1治疗小鼠的T细胞浸润增加。然而,该分析所针对的大多数其他生物标记物的影响都很小。值得注意的是,IO 360™面板通过对几种抗肿瘤活性的治疗参与提供非冗余的洞察,补充了流式细胞术数据。因此,使用IO 360™面板的NanoString分析可以通过揭示使用其他靶向方法可能会被忽略的机制活动,为丰富的数据集做出贡献。
IO 360™面板分析显示,抗mpd -1治疗增加了与T细胞存活相关的几个基因的表达。此外,在测量的细胞表面激活标记物中,流式细胞术分析显示抗mpd -1上调了CD8上的ICOS+T细胞,这是一种促进T细胞存活的受体。CD8中抗mpd -1未改变Ki-67增殖标志物水平+T细胞。因此,抗mpd -1处理对CD8的影响+T细胞浸润可能部分是由于icos驱动的T细胞存活基因上调。抗mpd -1还上调了调节STING通路信号、细胞毒活性和T细胞募集的几个基因。因此,提供了抗mpd -1驱动促进T细胞抗肿瘤反应的基因转录调控的额外证据。与驱动M1 TAM极化相关的基因也被抗mpd -1上调。其中包括Nos2 (iNOS),它在肿瘤来源的巨噬细胞中也被流式细胞仪证实,这表明治疗增强了TME中髓系间室中的一些促炎信号,以帮助对抗肿瘤生长。
NanoString分析还表明,基因图谱可用于识别未来研究的联合治疗伙伴,以实现附加或协同结果在活的有机体内.最引人注目的发现之一是治疗组中编码IDO1、TIM-3和CSF1R的基因上调,这些基因提供了促进肿瘤生长的信号,目前也在临床工作的各个阶段被靶向。这些基因的调节可能是肿瘤在PD-1/PD-L1阻断作用下逃避免疫系统的另一种尝试。因此,联合使用抗mpd -1和epacadostat、RMT3-23或PLX5622分别抑制MB49肿瘤模型中IDO1、tim3或CSF1R,可能有助于抑制抗mpd -1治疗引发的促肿瘤反应,提高疗效。测试这些假设的研究目前正在设计中。
有关NanoString功能的更多信息,请访问:https://drugdevelopment.labcorp.com/industry-solutions/oncology/金博宝188网址preclinical/in-vitro/dna-rna-expression-analysis.html
参考文献
1阿马特雷,F.,戈维尔,L.和奥利弗,D.(2018)。诱导共刺激剂(ICOS)是抗癌治疗的潜在靶点。专家对治疗靶点的意见,22(4), 343 - 351。
2库马尔,V.,帕特尔,S.,奇加诺夫,E.和加布里洛维奇,D.(2016)。肿瘤微环境中骨髓源性抑制细胞的性质。免疫学趋势, 37(3), 208-220。
3.陈强,孙丽,陈志军(2016)。细胞质DNA传感cGAS-STING通路的调控与功能。自然免疫学,17(10) 1142 - 1149。
4洛哈德,S.,布尔乔亚,N.,梅莱,L.,戈蒂埃,F., Fétiveau, A.,拉斯拉,H.,…& Barillé-Nion, S.(2020)。sting依赖的旁分泌形成乳腺肿瘤的凋亡启动,以响应抗有丝分裂治疗。自然通讯,11(1)论文。
5艾默里奇,Mumm, j.b.,陈,i.h.,拉菲斯,D.,张,H.,麦克拉纳汉,T.,…& Oft, M.(2012)。IL-10直接激活并扩展肿瘤驻留的CD8+ T细胞,而不需要从次级淋巴器官重新浸润。癌症研究,72(14), 3570 - 3581。
6史密斯,G. A.,陶顿,J.,维斯,A.(2017)。IL-2Rβ丰度调节CD4+和CD8+ T细胞中IL-2信号动力学的差异。科学的信号,10(510)。
7柯南,海因泽尔,卡灵顿,e.m.,哈波,L.,亚历山大,W. S.,张俊贵,…霍奇金,p.d.(2013)。IL-7R和抗原受体诱导信号对T细胞存活的互斥调节自然通讯,4(1), 1 - 10。
8维尔格姆,A. E.和里士满,A.(2019)。趋化因子调节肿瘤发生、转移和免疫治疗反应中的免疫监视。免疫学前沿,10, 333年。
9劳奇,Müller, M., &德克尔,T.(2013)。干扰素对炎症的调节及其STATs。Jak-Stat,2(1) e23820。
注意:所有的动物工作都经过现场机构动物护理和使用委员会的批准,并在aaalac认可的项目中按照《实验室动物护理和使用指南》进行。人道安乐死标准在所有研究中都是预先确定的。
连接
让我们开始对话吧
188 bet 服务中心