作者:大卫·德雷珀,博士,体外手术科学家
日期: 2018年1月
在这篇文章中,我们将介绍使用磷流式细胞术检测实体肿瘤中的磷蛋白,并回顾cabozantinib诱导的抑制肿瘤与宿主免疫细胞中PI3K/AKT和JAK-STAT信号的分析。
的在活的有机体内小分子抑制剂的疗效通常是通过测量药物靶向通路内细胞信号蛋白的磷酸化状态来评估的。当需要分析实体瘤时,这可能是一个挑战。在使用啮齿动物模型的临床前研究中,肿瘤分析最常用的方法是免疫印迹和基于elisa的技术。然而,这些批量分析方法有两个主要缺点。它们同时测量多个目标的相对能力是次优的。更重要的是,它们无法分析异质性肿瘤样本中多个不同子集中的靶点。当目标信号蛋白在肿瘤微环境中的不同细胞类型(如免疫细胞和肿瘤细胞)中具有相反的功能时,这可能是重要的,甚至当药物诱导效应发生在一个亚群而不是两个亚群时,这可能是至关重要的。
Labcorp开发了一种新型产品phospho-flow-based平台它可以同时分析宿主免疫细胞和来源于实体肿瘤的肿瘤细胞间室中的多个细胞信号转导靶点。在磷蛋白分析之前,通过泛造血细胞标记物CD45的免疫表型将肿瘤细胞与浸润的宿主免疫细胞区分开来。为了证明该平台的实用性,我们在接受FLT3抑制剂cabozantinib治疗的小鼠的皮下MV-4-11肿瘤中测量了磷酸化的STAT5和AKT (S6)的下游靶点水平。图1显示cabozantinib降低人(h)CD45+肿瘤细胞中pS6和pSTAT5的水平。在小鼠(m)CD45+宿主免疫细胞中未观察到这些磷蛋白水平的变化(未显示)。因此,我们了解了PI3K/AKT和JAK-STAT信号活性,它们是调节肿瘤生长和宿主免疫的良好通路,是治疗干预的有吸引力的靶点。
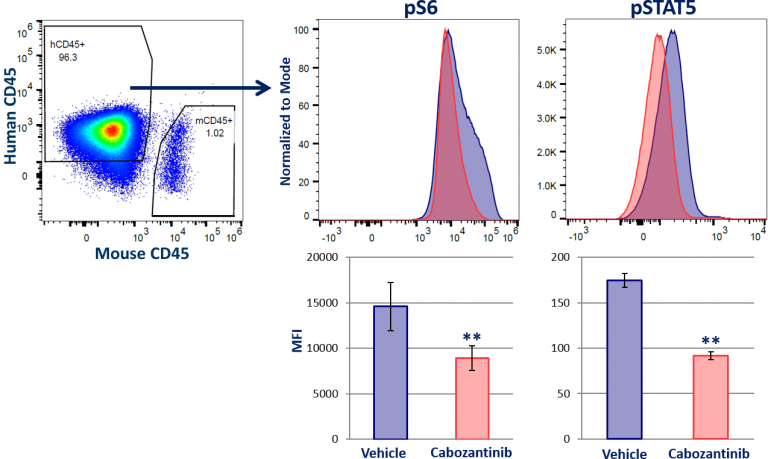
图1:实体肿瘤STAT5和MAPK信号的磷酸化流分析。
MV-4-11是急性髓系白血病(AML)的模型,这是一种由几种基因中的一种基因突变引起的恶性肿瘤。最常见的事件发生在FLT3基因中,其结果是组成性活性的FLT3蛋白,通过触发PI3K/AKT和JAK-STAT信号的过度激活来驱动癌细胞增殖。1cabozantinib介导的FLT3抑制已被证实可以抑制MV-4-11肿瘤的生长在活的有机体内,这与抑制AKT和STAT信号有关在体外.2虽然在许多模型中,过度活跃的PI3K/AKT和JAK-STAT5信号通路已被充分证明驱动肿瘤生长,但这些信号蛋白的活性也是T细胞激活和生成记忆T细胞形成所必需的。3、4、5这种二分法强调了能够同时分析实体肿瘤来源的免疫细胞和肿瘤细胞中的磷蛋白的重要性。
肿瘤磷流在Labcorp有潜力推进细胞信号转导领域。2010年在肺和腹膜肿瘤中描述了固体组织磷流。6从那以后,关于其他成功方法的报道就很少了。最近,一种被称为“解剖”的方法与细胞术相结合,并成功地用于测量上皮细胞样本中的磷蛋白,以及后来的结直肠肿瘤7, 8应该注意的是,这些方法需要在组织采集后固定,这可能会改变与荧光抗体结合的表位,用于免疫表型和信号分析。这可能会限制技术提供的数据量。Labcorp的实体肿瘤磷流在免疫染色前不需要固定。这促进了我们针对不同人群进行分析的能力。我们正在努力扩大我们的能力。目前的工作重点是开发新的实体肿瘤磷流服务,这将使分析体内治疗诱导的特异性T细胞亚群和肿瘤细胞同时。
联系我们了解更多关于实体肿瘤磷流的信息,以及我们可以提供分析的信号蛋白扩展列表的信息。
参考文献
2吕建伟;王安宁;廖海安;陈春英;侯,H. A.;胡春燕;林丽丽(2016)。Cabozantinib对具有flt3 -内部串联复制(FLT3-ITD)的急性髓系白血病细胞具有选择性细胞毒性。癌症的信,376(2), 218 - 225。
3.瓦拉,J. Á。f;Casado大肠;德卡斯特罗;Cejas p;Belda-Iniesta c;& González-Barón, M.(2004)。PI3K/Akt信号通路与癌症癌症治疗综述,30.(2), 193 - 204。
4拉尼、墨菲(2016)。cantrell, D.(2002年2月)。
5蛋白激酶B (Akt)在T淋巴细胞中的调控作用。在免疫学研讨会(第14卷第1期,19-26页)。学术出版社。
6林c.c.;黄文林;苏伟平;陈慧慧;赖伟伟;颜俊杰;苏文昌(2010)。单细胞特异性流式细胞术可检测肺癌细胞中磷酸化Stat1水平的动态变化。细胞分析A部分,77(11), 1008 - 1019。
7西蒙斯,A. J.;巴纳吉,a;e.t.麦金利;C. R.斯克拉;Herring, c.a.;盖温,l.s.;&爱尔兰,J. M.(2015)。基于细胞术的完整上皮信号的单细胞分析显示,MAPK激活与TNF - α诱导的体内凋亡不同。分子系统生物学,11(10), 835年。
连接
让我们开始对话吧
188 bet 服务中心

