作者:迪伦·丹尼尔,博士,科学发展部主任
日期: 2017年7月
胰腺导管腺癌(PDAC)是最常见的胰腺癌,约占所有病例的95%。2017年,美国约有50987人被诊断为PDAC,约有40936人死亡,使PDAC成为最致命的癌症之一。在美国,以抗代谢药物和抗有丝分裂紫杉烷为基础的联合化疗是标准的治疗方案,但从历史上看,这些治疗方案只能将总生存率提高数周。对治疗胰腺癌的新治疗方法的迫切医疗需求尚未得到满足。
由于许多治疗胰腺癌的新方法都遭遇了令人失望的临床结果,许多药物研发科学家在最近利用免疫系统治疗其他癌症的成功基础上,转向了胰腺癌的免疫疗法。尽管同基因小鼠胰腺癌细胞系数量有限,但Labcorp已将Pan02 PDAC模型用于免疫肿瘤学应用。Pan02来自于给予原位3-甲基胆蒽的C57BL/6小鼠,对许多标准化疗药物都是耐药的。1Pan02中含有功能缺失突变SMAD4在大约30%的人类胰腺癌中,与失活突变功能相似的基因。2
平均和个体生长曲线
Labcorp维持Pan02作为可移植片段模型,其平均生长动力学(图1A)和单个动物生长曲线(图1B)。Pan02的肿瘤平均加倍时间为6天,比大多数同基因小鼠细胞系肿瘤慢。这种缓慢的生长可能使免疫治疗更容易控制,因为在肿瘤达到安乐死标准之前,治疗方法有时间修改免疫系统并激发抗肿瘤活性。
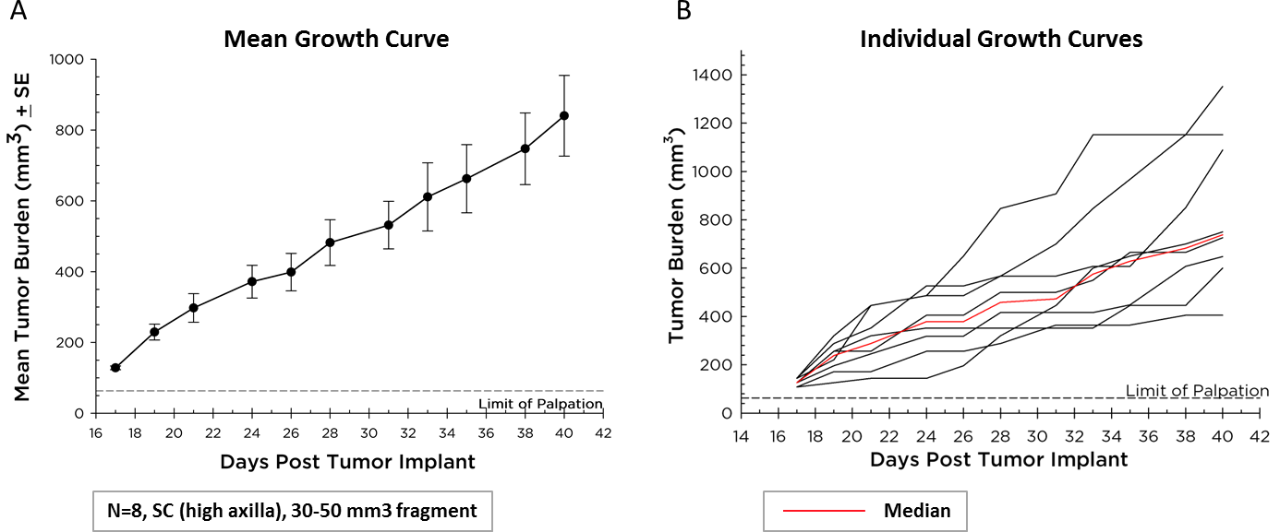
图1 (A&B) - Pan02胰腺癌在C57BL/6小鼠中的生长
抗pd -1和抗ctla -4的疗效和生存率
目前,针对CTLA-4、PD-1和PD-L1的T细胞检查点抑制剂抗体已被批准用于非胰腺癌。我们在Pan02模型中单独和组合测试了抗ctla -4(克隆4F10)和抗pd -1(克隆RMP1-14)。植入后3天开始给药,各组平均肿瘤负荷显示无明显活性(图2A)。通常情况下,免疫疗法可能只在接受治疗的动物的一个子集中显示活性,因此单个动物图对检测那些应答者是有价值的。然而,单个动物图中并没有显示出在对照组中没有观察到的任何试验药剂的显著活性(图2B)。此外,正如根据生长反应数据所预期的那样,与对照组相比,治疗组的生存率没有改善(图3)。
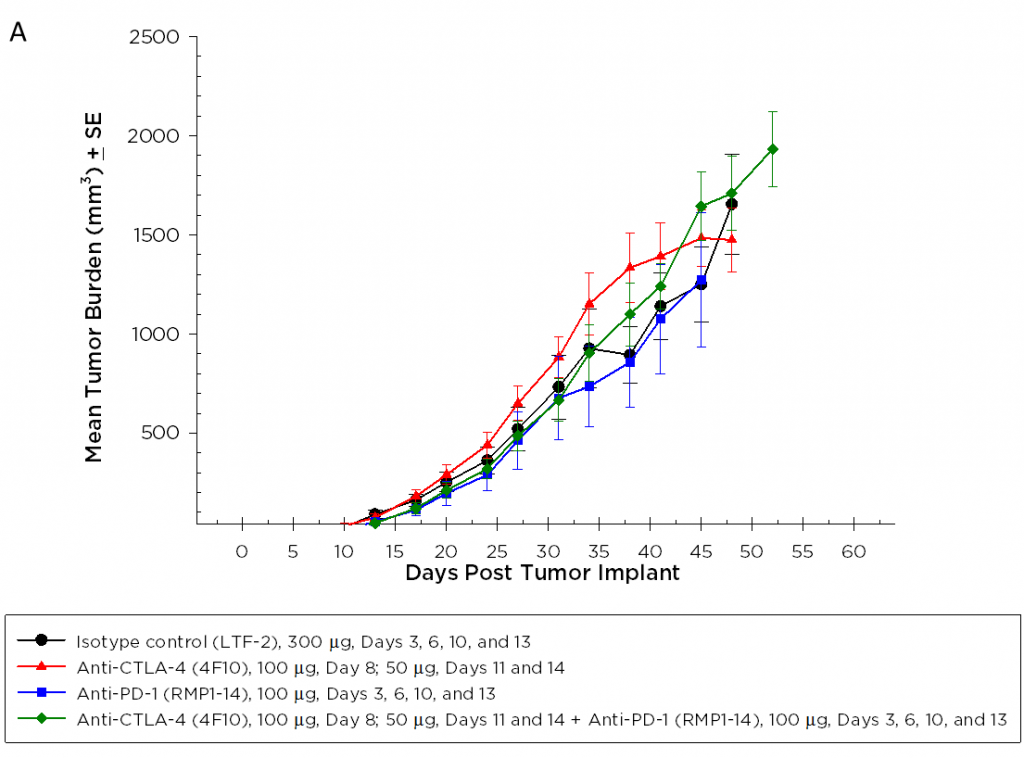
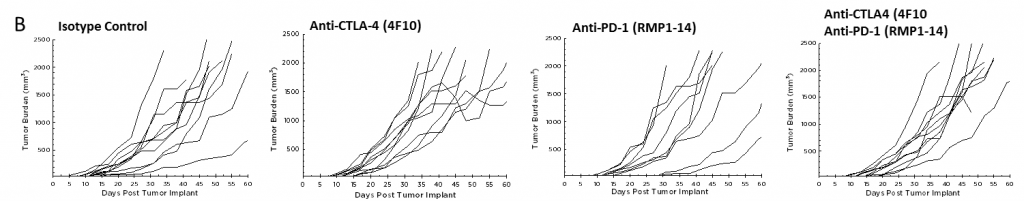
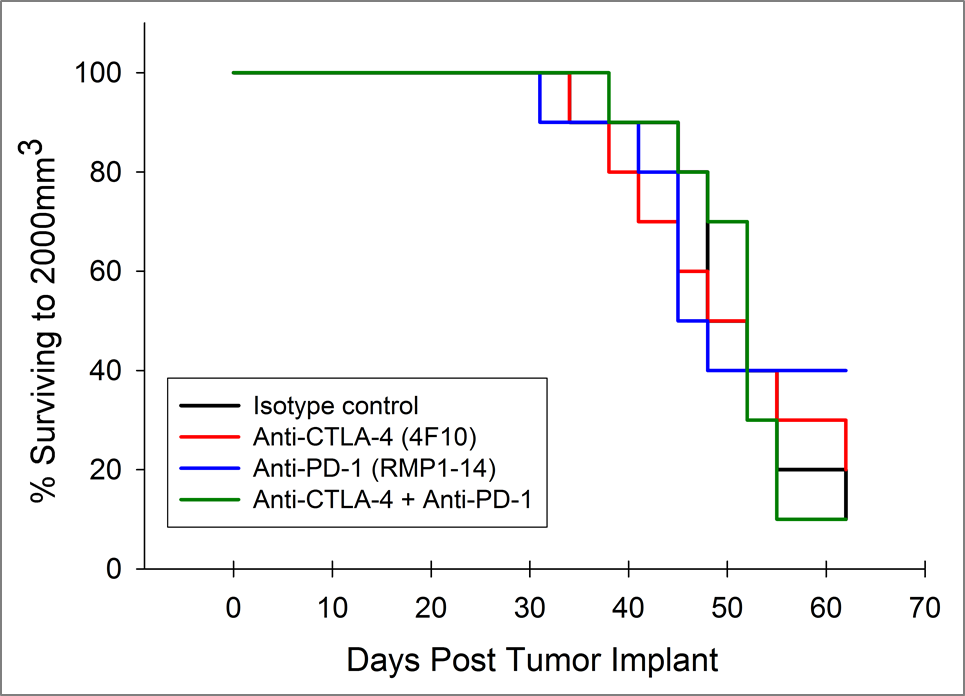
图3:抗pd -1和抗ctla -4治疗Pan02荷瘤小鼠的存活率
免疫分析
我们想确定检查点抑制剂是否对Pan02肿瘤中的免疫细胞浸润有影响。在图4中,显示了总CD45+白细胞、CD4+ T细胞、CD8+ T细胞、调节性T细胞(treg)、单核细胞髓系衍生抑制细胞(M-MDSC)和粒细胞性mdsc (G-MDSC)的免疫谱。
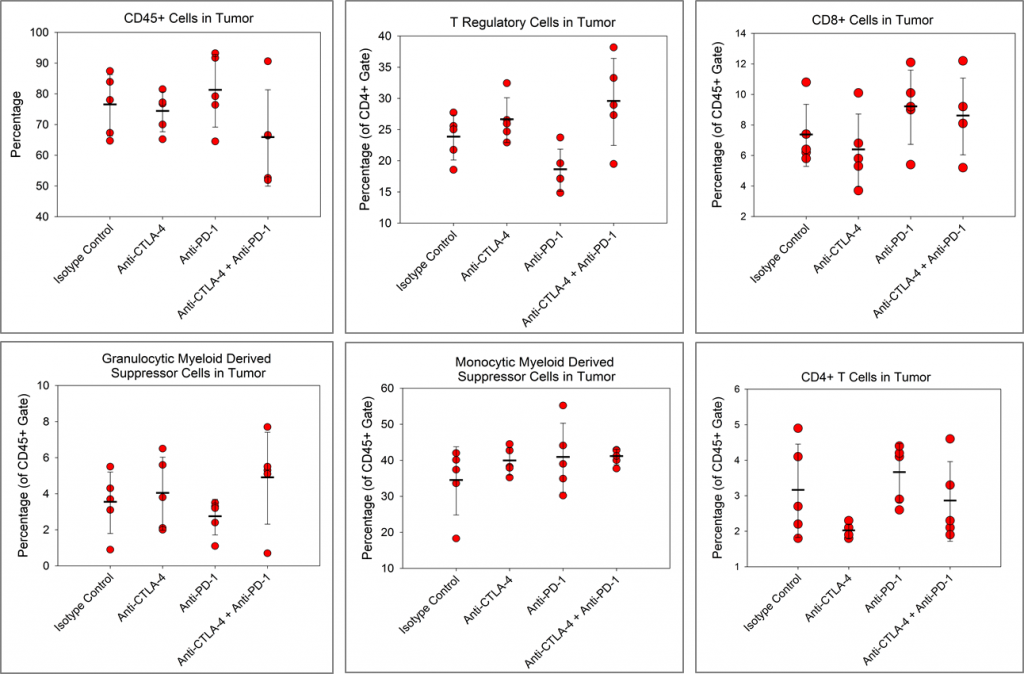
虽然与同型对照相比,抗ctla -4治疗组CD4+ T细胞有减少的趋势,抗pd -1治疗组treg有减少的趋势,但未观察到其他免疫变化。尽管检查点抑制剂单独在Pan02模型中没有明显的活性,但已有报道显示,检查点抑制剂在Pan02肿瘤中与radiation3或共刺激激动剂抗cd40抗体一起具有活性重要的是,在这些研究中,抗pd - l1与抗cd40和放疗有很强的协同作用,这表明虽然Pan02肿瘤对单药检查点抑制剂无效,但检查点抑制可以促进联合伙伴的活性。
请与我们的科学家联系,了解如何将Pan02或我们的其他同基因模型用于您的下一个免疫肿瘤学研究。
参考文献
2王燕等,小鼠胰腺癌细胞关键基因的基因组测序。2012。当代医学,Vol. 12(3): 331-341。
3.Azad A等人,PD-L1阻断增强胰腺导管腺癌对放疗的反应。2017.EMBO摩尔医学第9卷:167-180。
连接
让我们开始对话吧
188 bet 服务中心

