作者:Sumithra Urs,博士|科学家,科学发展
日期: 2019年6月
胰腺癌是第九大最常见的癌症,也是最致命的癌症之一,最低的5年生存率为5-8%。(1、2、3)仅在今年,美国癌症协会估计将有56770人被诊断出患有这种疾病,其中超过45750人可能无法存活。胰腺导管腺癌(PDAC)是外分泌胰腺癌最常见和最具侵袭性的形式,占死亡率与发病率相等的病例的90%。(4、5)
在诊断时,绝大多数PDAC患者要么是局部晚期,无法切除,要么是转移性疾病。疾病的无声传播,以及只有在晚期才出现疾病特定症状,使得早期发现非常具有挑战性,并导致生存率低。可切除患者的治疗方案包括手术后一线全身化疗(吉西他滨,FOLFIRINOX,紫杉醇)或联合放化疗。对于局部晚期、不能切除的患者,该方案包括多药化疗(5-FU、奥沙利铂、伊立替康)或放化疗。[6]由于这些治疗对胰腺癌患者的益处有限,免疫治疗药物等更新的选择现在正在临床试验中进行测试。
PDAC的特点是存在纤维化间质,低突变负担,缺乏CD8+T细胞浸润和免疫抑制骨髓细胞群的存在,所有这些都有助于典型的非免疫原性肿瘤特征。[7]目前增强治疗反应的方法集中在使用放射治疗(RT)等药物增加T细胞向肿瘤的运输。在大多数实体肿瘤中,单独的RT有可能激活免疫系统,在细胞毒性死亡和释放免疫刺激信号后触发抗肿瘤免疫反应。然而,在PDAC患者中,单独高剂量RT或联合化疗药物的结果通常仍不令人满意[8]单剂免疫疗法的临床试验表明反应率低至1-2%。[9]目前至少有21项开放临床试验正在研究RT与其他免疫刺激药物的联合使用,这可能是治疗PDAC的一种有前途的途径,值得进一步研究。[10]与此同时,在临床前平台中,我们正在使用Pan02小鼠PD金博宝188网址AC模型评估单一和联合疗法。Pan02是通过3-MCA(3-甲基胆蒽)化学诱导在雄性C57BL/6小鼠中建立的III级腺癌模型。[11]在这个模型聚光灯下,我们展示在活的有机体内在同基因C57BL/6小鼠品系中测试了Pan02肿瘤模型生长动力学、对免疫调节抗体的反应、局灶性辐射以及RT与免疫调节剂联合使用的数据。
Pan02生长参数
Pan02皮下植入成功建立肿瘤,中位倍增时间为4-5天,植入后小鼠在研究中停留约30天(图1),体重没有减轻(数据未显示)。生长动力学允许超过三周的治疗窗口来评估该模型中的抗肿瘤反应。

流式细胞术对Pan02肿瘤进行免疫分型分析,证实淋巴样细胞浸润较差(图2) + 和CD4 + 辅助T细胞仅占CD45的1.6%和1% + 群体,分别,免疫抑制骨髓细胞群体存在丰富。M-MDSCs和M1、M2 TAMs为优势细胞亚群。这种肿瘤免疫特征是非免疫原性或“冷”肿瘤模型的特征,类似于在PDAC患者中观察到的情况。

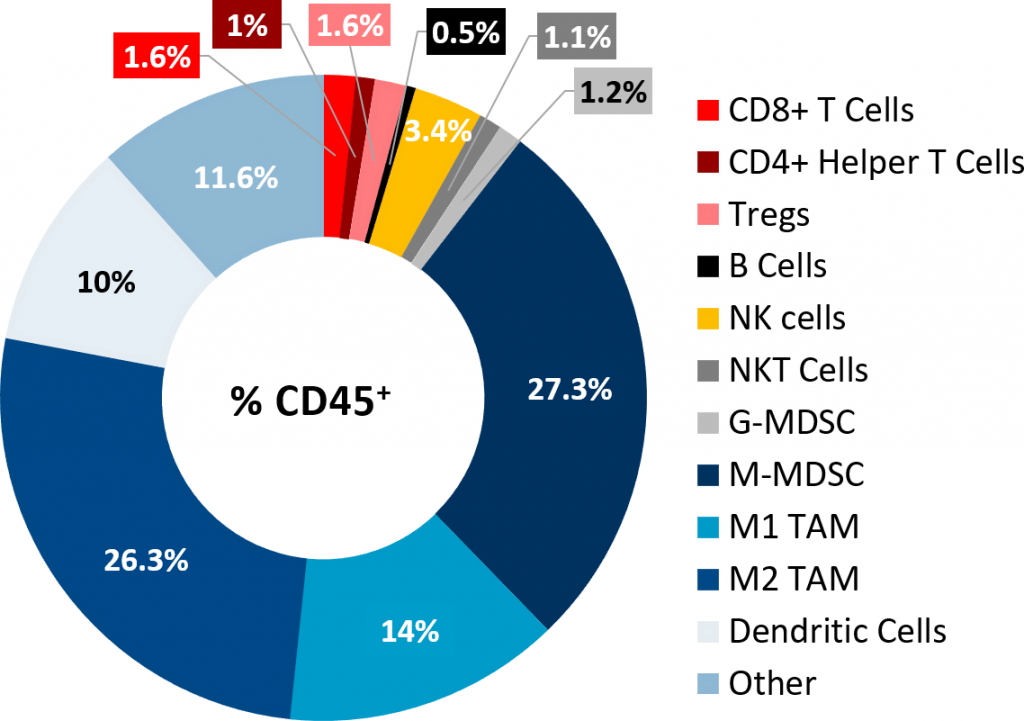
图2:皮下Pan02肿瘤的肿瘤免疫谱。
Pan02对单药处理的反应
胰腺癌患者最常用的化疗方法之一吉西他滨(100mg/kg, Q3Dx4)单药治疗Pan02荷瘤小鼠耐受性良好,并产生统计学意义上的肿瘤生长延迟(TGD)(图3)。

图3:Pan02对吉西他滨的反应。
鉴于PDAC临床免疫疗法的研究,我们开始评估我们的Pan02模型对各种免疫调节抗体的反应性(图4)。然而,与Pan02肿瘤的免疫抑制特征一致,该模型对检查点抑制剂抗mpd -1、抗mpd - l1和抗mctla -4以及共刺激抗体抗mcd137和抗mox40的反应极低或无反应也就不足为奇了。所有抗体每周两次,10mg/kg,共4次(图4)。

图4:Pan02对免疫调节抗体的反应。
Pan02对放射和联合治疗的反应
放射治疗通常用于PDAC患者。在我们的小鼠模型中,我们使用了小动物辐射研究平台(SARRP;Xstrahl)将单剂量局灶辐射(5Gy或10Gy)直接照射到肿瘤,我们观察到与未治疗对照组相比,剂量依赖性肿瘤生长延迟分别为9.5天和22天(图5)。
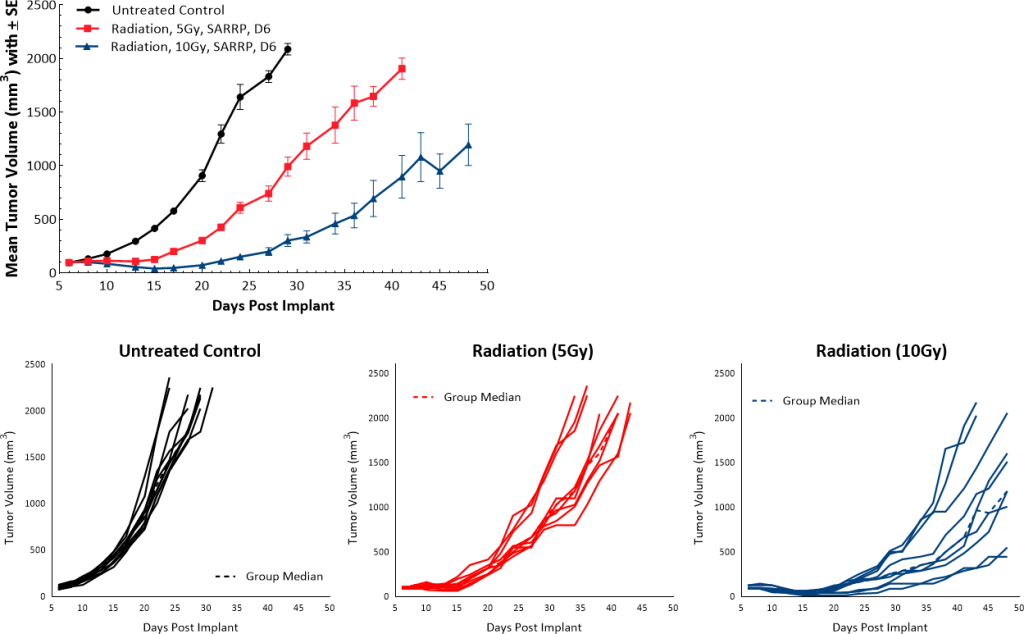
图5:Pan02对焦点辐射的响应。
为了研究RT联合检查点抑制剂的抗肿瘤作用,单剂量5Gy与抗mpd -1或抗mpd - l1抗体一起使用。未处理组和同型对照组的生长速率重叠,单剂检查点抑制剂抗mpd -1和抗mpd - l1治疗没有引起任何抗肿瘤反应。虽然单剂量5Gy RT比未治疗对照组的TGD为9.5天,但与检查点抑制剂联合使用对改善抗肿瘤反应没有显著贡献。抗mpd -1或抗pd - l1的RT分别导致TGD为13天和11.2天(图6)。
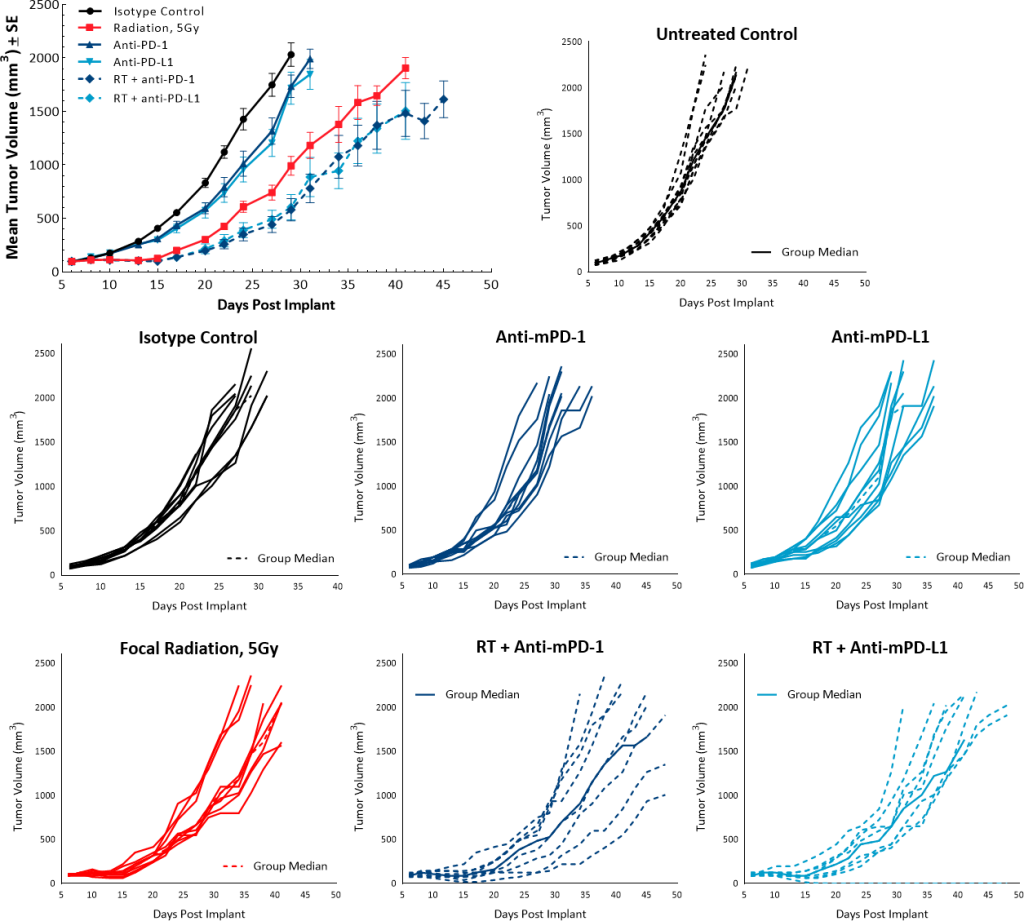
图6:Pan02对辐射和检查点抑制剂组合的反应。
Pan02模型的未来工作
研究正在评估使用多种组合来改善皮下Pan02模型治疗反应的潜力。此外,我们最近还生成了一个luciferase-enabled Pan02细胞系支持原位研究。
参考文献
2癌症统计事实。国家癌症研究所。(https://www.cancer.gov)。
3.胰腺癌行动网络(https://www.pancan.org/).
4甘德森j,山崎T,麦卡蒂K等。在胰腺腺癌小鼠模型中阻断成纤维细胞激活蛋白联合放射治疗。科学通报,2019,14(2):e0211117。
5Kabacaoglu D, Ciecielski KJ, Ruess DA和Algul H.免疫检查点抑制对胰腺导管腺癌:目前的局限性和未来的选择。免疫学前沿2018,9:1876。
6尚敏,郑玲。现行胰腺癌化疗标准。中国。其他。2017年,39(11):2125 - 2134。
7张志强,张志强,张志强等。PD-L1阻断增强胰腺导管腺癌对放疗的反应。中国生物医学工程学报,2017,29(2):379 - 379。
8劳佛DC,库恩PA, Kueng M等。胰腺癌:未切除和R1切除患者放化疗加大剂量放疗的可行性和结果。2018.Cureus 10(5): e2713。
9Javle M, Golan T和Maitra A.改变胰腺癌的进程-关注最近的翻译进展。癌症治疗评论,2016;44:17-25。
10Gajiwala S, Torgeson A, Garrido-Laguna I, Kinsey C, and Lloyd S.胰腺癌的联合免疫治疗和放射治疗策略-靶向癌症免疫周期中的多个步骤。J Gastro Oncol, 2018;9(6): 1014 - 1026。
连接
让我们开始对话吧
188 bet 服务中心

